Porque é que a água não é produzida em massa se conhecemos a sua fórmula molecular?
A crise da água obriga-nos a trabalhar em novas tecnologias para a reutilização do recurso mais precioso para a vida. Mas talvez tenha pensado porque é que não a criamos do zero nos laboratórios, se já sabemos que o H2O é a sua "receita".

Sabemos da existência de vários métodos físicos e químicos de captação, dessalinização, purificação, potabilização e redistribuição da água para reutilizar este recurso vital. Embora as tecnologias estejam a avançar neste domínio com métodos melhorados e mais eficientes, não é suficiente e a crise da água continua a agravar-se.
Da união de dois átomos de hidrogénio (H) e um de oxigénio (O) obtém-se: H2O (monóxido de di-hidrogénio), que é a fórmula molecular da água. Temos os ingredientes disponíveis mas, obviamente, alguns dos passos desta "receita" não devem ser simples de fazer em laboratório, e há razões para não a criar em massa.
É possível fabricar água?
Sim, o processo de "fazer" água a partir do zero é possível, mas há uma (ou duas) razões fundamentais para que não seja feito em grande escala. É por isso que a ciência está continuamente à procura de alternativas tecnológicas para conseguir o melhor método de reutilização da água, porque não somos capazes de criar fontes inesgotáveis de "água nova artificial" em grande escala, e muito menos de as instalar em pontos estratégicos do planeta para acabar com a crise da água. Dizemos-lhe porque é que a água não pode ser feita a partir do zero.
Criação de água: eletrólise e fotólise
A água no laboratório pode ser obtida através de dois processos principais: a eletrólise e a fotólise.
A eletrólise é o processo pelo qual a água é dividida nos seus componentes básicos, o oxigénio e o hidrogénio, através da aplicação de uma corrente elétrica. O oxigénio é libertado num elétrodo e o hidrogénio no outro. Estes dois gases podem então ser recolhidos e recombinados para criar água novamente. Este processo é utilizado em algumas aplicações industriais, como a produção de hidrogénio como combustível.

A fotólise, por outro lado, envolve a separação da água nos seus componentes básicos através da exposição à luz. Isto é conseguido através da utilização de um fotocatalisador, que é um material que absorve a luz e catalisa a reação química. O oxigénio e o hidrogénio podem então ser recolhidos da mesma forma que na eletrólise.
Ambos os métodos de criação requerem enormes quantidades de energia, tornando o processo ineficiente e extremamente perigoso. No entanto, estes processos são essenciais nalgumas aplicações industriais e podem ter implicações importantes na investigação de tecnologias verdes e na produção de combustíveis limpos.
Avanços na produção de água
Há anos que os cientistas trabalham para encontrar formas de criar água, e um grupo líder do Departamento de Química da Universidade de Illinois, nos EUA, publicou em 2007 uma nova forma de produzir água sem uma grande explosão. No entanto, este processo continua a ser muito dispendioso e ineficaz, mas pode ser utilizado para outro objetivo importante.
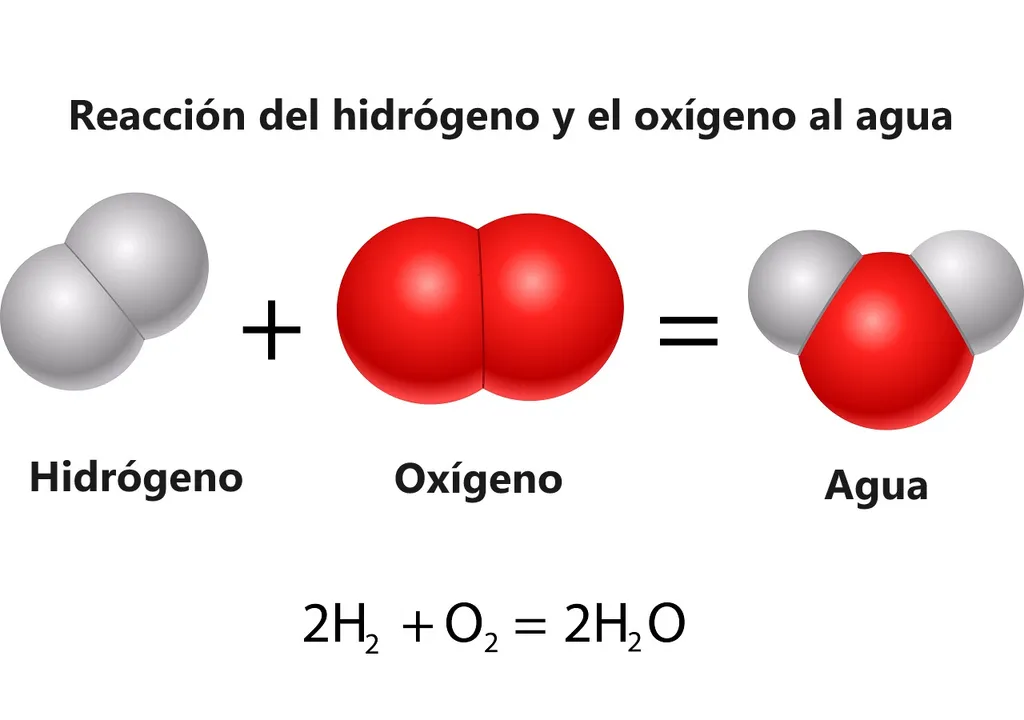
"A reação (2H2 + O2 = 2H2O + Energia) é conhecida há séculos, mas até agora ninguém a tinha feito funcionar numa solução homogénea", afirmou Thomas Rauchfuss, professor de química na universidade e principal autor do estudo.
A conhecida reação também descreve o que acontece no interior de uma célula de combustível a hidrogénio. Numa célula de combustível típica, o hidrogénio gasoso diatómico (H2) entra por um lado da célula e o oxigénio gasoso diatómico (O2) entra pelo outro lado.

As moléculas de hidrogénio perdem os seus eletrões e ficam com carga positiva através de um processo chamado oxidação, enquanto as moléculas de oxigénio ganham quatro eletrões e ficam com carga negativa através de um processo chamado redução. Os iões de oxigénio carregados negativamente combinam-se com os iões de hidrogénio carregados positivamente para formar água e libertar energia elétrica.
O "lado difícil" da célula de combustível é a reação de redução do oxigénio e não a reação de oxidação do hidrogénio, disse Rauchfuss. "No entanto, descobrimos que novos catalisadores para a redução do oxigénio podem também conduzir a novos meios químicos para a oxidação do hidrogénio".
Rauchfuss e Heiden investigaram recentemente uma geração relativamente nova de catalisadores de hidrogenação de transferência para utilização como hidretos metálicos não convencionais para redução de oxigénio.
Estes investigadores centram-se na reatividade oxidativa dos catalisadores de hidrogenação de transferência à base de irídio numa solução homogénea não aquosa. Verificaram que o complexo de irídio afecta tanto a oxidação de álcoois como a redução de oxigénio.
"A maioria dos compostos reage com hidrogénio ou oxigénio, mas este catalisador reage com ambos", disse Heiden. "Reage com o hidrogénio para formar um hidreto e depois reage com o oxigénio para formar água; e fá-lo num cartucho homogéneo e não aquoso." Os novos catalisadores podem levar ao eventual desenvolvimento de células de combustível de hidrogénio mais eficientes, reduzindo substancialmente o seu custo, disse Heiden.
A solução é: não poluir a água
No centro da crise da água está a constatação de que a água não se está a esgotar - a quantidade de água que temos na Terra sempre foi a mesma. O que está a acontecer é que a estamos a poluir e, em alguns locais, já não está disponível. Esta é uma das consequências da depredação dos ecossistemas (florestas e zonas húmidas, por exemplo), que fazem parte do ciclo da água, filtrando e também armazenando este recurso vital, deixando-o limpo e em quantidades suficientes.

Por conseguinte, temos de travar a poluição da água, devemos multiplicar a quantidade de vegetação e proteger os ecossistemas existentes.
Para além disso, há uma grande necessidade de aprender a gerir a água e a utilizá-la de forma consciente. Em números, a produção de um quilo de carne de vaca pode consumir entre 500 e 20 mil litros de água, dependendo do país e da proveniência da carne. Segundo dados da ONU, a indústria têxtil é responsável por 20% da água poluída do mundo; por exemplo, a produção de um par de calças de ganga requer entre 2 e 3 mil litros de água, de acordo com um estudo realizado na Universidade Politécnica de Madrid.